Na sessão clínica sobre transplante simultâneo rim – pâncreas, discutimos o caso de uma paciente de 35 anos, hipertensa e dislipidêmica, com diagnóstico de diabetes mellitus tipo 1 (DM1) desde os 12 anos e má adesão ao tratamento proposto desde o diagnóstico. Aos 29 anos, evoluiu com síndrome nefrótica e piora progressiva da função renal, com indicação de hemodiálise aos 34 anos de idade. Além da nefropatia diabética confirmada por biópsia renal, foram documentadas outras complicações microvasculares como retinopatia e neuropatia diabética.
Em janeiro de 2019, foi submetida a transplante rim pâncreas simultâneo, apresentando normalização da glicemia de jejum e da hemoglobina glicada (Hba1c), sem necessidade de uso de insulina após o transplante (Gráfico 1).
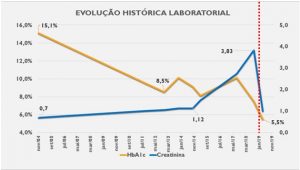
Gráfico 1 – Evolução histórica laboratorial – Linha vermelha pontilhada marca o momento do transplante simultâneo pâncreas- rim
Dentre as três modalidades de transplante pancreático, ou seja, transplante de pâncreas isolado, transplante de pâncreas após transplante de rim e transplante de pâncreas rim simultâneo, o último se mostrou o tratamento ideal para pacientes com DM1 e taxa de filtração glomerular menor que 20 mL/min, devido a maior taxa de sobrevida dos enxertos. Quando ocorre sucesso do transplante, definido por normalização da Hba1c e da glicemia de jejum e independência da terapia com insulina exógena, observa-se que os efeitos no metabolismo glicídico e lipídico se mantém pelo menos até 5 anos pós transplante. Além disso, há evidências na literatura sugerindo benefício após o transplante em complicações microvasculares do diabetes. A contrapartida, porém, são os riscos da imunossupressão crônica e complicações perioperatórias, que pressupõe, sempre, uma avaliação cuidadosa e individualizada dos riscos e benefícios para os pacientes candidatos.
O transplante rim pâncreas simultâneo, dessa forma, deve ser considerado como uma opção terapêutica em pacientes com diabetes mellitus (DM) em fase pré-diálise ou dialítica. Para auxiliar no raciocínio das possíveis condutas nestes casos, montamos o fluxograma abaixo (Fluxograma 1). Vale atentar que caso o paciente tenha indicação de diálise e não haja disponível transplante simultâneo rim–pâncreas no momento, o paciente deve ser submetido primeiramente ao transplante de rim, e posteriormente, quando disponível, ao transplante de pâncreas, a fim de reduzir a mortalidade elevada do paciente com DM em hemodiálise.
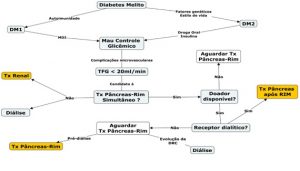
Fluxograma 1
Visto o benefício do transplante de órgãos, torna-se indispensável o papel do médico como propagador da vida, incentivando a adesão ao programa de doação de órgãos e trazendo a responsabilidade para a sociedade como um todo, tornando o cidadão um instrumento ativo, para que continuemos a admirar a arte da vida.
Referências:
EKSER, B. et al. Impact of duration of diabetes on outcome following pâncreas transplantation. Internacional Journal of Surgery (2015) 21-27
Angelika C. Pancreas Transplantation for Patients with Type 1 and Type 2 Diabetes Mellitus in the United States: A Registry Report. Gastroenterol Clin N Am 47 (2018) 417-441
LEHMANN, R. Glycemic Control in Simultaneous Islet-Kidney Versus Pancreas- Kidney Transplantation in Type 1 Diabetes. Diabetes care. 2015
The Diabetes Control And Complications Trial / Epidemiology of Diabetes Interventions and Complications Study at 30 years: Overview. Diabetes care. 2014.